新闻中心
在《Biacore检测蛋白与小分子相互作用的常见问题(上)》中我们着重介绍了在实验设计以及样品准备方面的问题,在本文的下篇中,我们还是从智荟专线收集的客户咨询出发,将继续讨论在实验进行过程中和最终的数据分析阶段可能遇到的常见问题,并逐一揭开上篇中遗留的各个悬念……
一、 关于溶剂校正的问题
溶剂校正流程贯穿于前期的样品准备、之后的样品检测以及最后的数据分析,是检测蛋白与小分子相互作用实验中非常关键的一个步骤,也是Biacore检测蛋白与小分子互作的一大优势。
什么情况下需要进行溶剂校正?
当运行缓冲液中含有高折光率(refractive index)的成分,且此时在活通道上的配体量较高时,运行缓冲液流经活性通道时会存在一定的体积排阻效应,导致活性通道与参比通道上的信号存在差异[1](如下图1所示)。

1. 运行缓冲液的高折光率与高偶联造成活性通道与参比通道的信号差异[1]。
如果运行缓冲液以及不同浓度的分析物样品的折光率能保持严格一致,则上述的通道间差异也是一个定值了,将不会对最终互作结果产生影响;然而实际情况下,由于样品配制误差等原因,缓冲液与分析物样品间的折光率误差往往难以避免。以DMSO为例,1% DMSO的加入会导致响应值信号上升约1200 RU[1],而小分子分析物本身与配体结合产生的响应值是较小的,因此DMSO浓度的微小变化也会引起显著的影响。此时就需要进行溶剂校正,来修正这种由于高折光率物质(例如DMSO等)浓度的细微偏差导致的响应值信号显著变化,得到最准确的互作数据。
2如何进行溶剂校正?
以最常见的DMSO为例,溶剂校正的核心思路是设置一系列含有不同浓度DMSO的校正溶液,浓度范围覆盖实验中所用的DMSO浓度(例如运行缓冲液和分析物样品中均含5% DMSO,则校正溶液中浓度范围可以是4.5% - 5.8%),以此来包含样品与buffer配制过程中引入的DMSO浓度的误差。使校正溶液按照浓度顺序(从低到高或者从高到低)依次进样,流经参比通道与活性通道后,以参比通道的响应值为横坐标、活性通道扣减参比通道的响应值为纵坐标进行作图,得到溶剂校正曲线(如下图2所示)。根据样品在参比通道的信号,就可以通过校正曲线对应得到活性通道扣减参比通道的校正值。而此过程在Biacore上,都是全自动完成的,有专用向导式程序指引,无需手动操作。
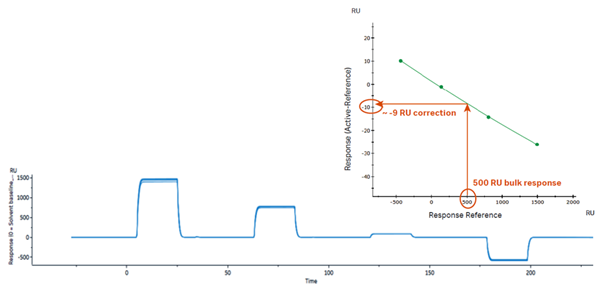
2. 典型的溶剂校正曲线示意图[1]。
3
如何判断溶剂校正的结果是否正常?
如果按照上述的例子,对含有5% DMSO的样品以4.5% - 5.8%的范围进行溶剂校正,最终得到的溶剂校正曲线横坐标范围一般要落在-500 到 +1000 RU,校正曲线图谱中的两条竖线代表的是分析物中DMSO浓度范围,要求落在校正曲线的范围内,并且拟合的Chi²值小于2[1][2]。
如果溶剂校正的结果出现异常,可以留意以下几方面的问题:(1)建议使用高品质的DMSO试剂,并且使用相同来源的DMSO溶解小分子和配制所需溶液。(2)注意校正溶液的配制策略,例如只需配制含4.5%和5.8% DMSO的这两种缓冲液,中间梯度通过这两种溶液按照不同比例混合得到,而不需要一个个单独配制。(3)由于DMSO具有吸潮的性质,在配制过程中应及时封闭,避免长时间敞口放置;在上机检测时,也应该对样品管进行密封。为此,Biacore独特的全密闭样品舱设计,及配套专用的孔板封膜及EP管橡胶盖就派上用场了。
关于溶剂校正步骤的具体操作方法,可以扫描文末二维码,查阅《Easy Biacore: T200 检测蛋白与小分子结合》中的相关内容。
二、结果分析中的相关问题
正确的溶剂校正是后续进行数据分析的前提,得到最终可分析的结果后,可能还面临下面这些问题。
1
应该选择哪种拟合模式?
关于拟合模式的选择,是选择动力学(Kinetics)分析还是亲和力(Affinity)分析,主要是根据响应值图谱的形状来判断的。对于动力学分析,要求响应值图谱在结合和解离阶段均展现出足够的曲率(“慢结合慢解离”),而亲和力分析则要求在每次的分析物进样阶段均达到稳态(steady state)。对于同时满足两种要求的响应值图谱,理论上两种分析模式均可以使用。关于不同响应值图谱形状以及可选的拟合模式,可参考如下图3[3]。
3. 不同形状的响应值图谱与适用的拟合模式的对应关系示意图[3]。
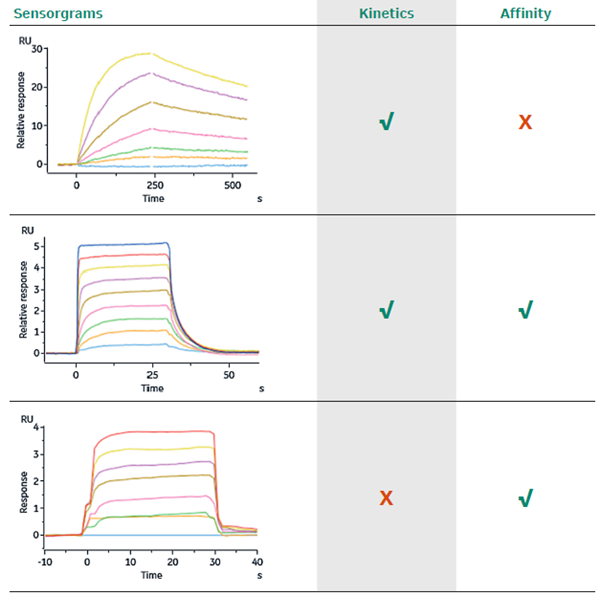
如同在上篇所提到的,蛋白与小分子的相互作用在大部分情况下是“快结合快解离”的,在结合与解离阶段的曲线未能呈现足够的曲率,而在每次分析物进样后,曲线快速上升并达到平台,因此适用于亲和力(Affinity)分析。而在解离阶段曲线快速下降至接近基线的特点,也使得蛋白与小分子互作检测中一般不需要设置额外的再生步骤。
2
如何判断拟合结果的好坏?
这是很多实验者在面对自己的实验结果时会发出的“灵魂拷问”,同样也是Biacore另一个独特优势体现之处:具有智能数据质量评估系统,能够以图形化显示方式来评估检测结果。能够对检测结果自动进行统计学分析,并给出相应参数,以此判断数据可信度与准确度。由于篇幅有限,我们这里主要讨论蛋白与小分子互作常用的亲和力分析结果的评价。
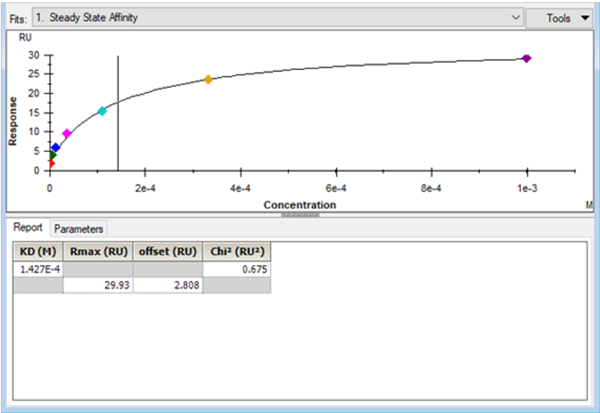
是使用Biacore结果分析软件得到的典型的亲和力分析结果,在Report界面,显示的参数有KD(以M为单位)、Rmax、offset以及Chi²,相应的判断标准如下:
1
拟合得出的KD值(即拟合曲线中竖线所在的横坐标值)应该尽可能落在分析物浓度范围之内,最好在最高浓度的一半以内。
2
当拟合得到的实际Rmax值显著高于理论计算值时,说明结合反应未按照1:1的化学计量比进行,有可能出现了非特异性结合或者分析物分子的聚集。对于小分子样品来说,往往由于溶解度等问题发生聚集导致上述现象。而造成拟合得到的实际Rmax值低于理论计算值的原因,主要还是偶联的配体中有一定比例的分子未充分暴露结合活性。如果上述两种情况同时存在,此时仅通过Rmax值难以判断,需要通过其他实验结果来验证。
3
offset代表的是零浓度时的响应值,这个值应该趋近于0;如果出现了异常高的值或者负值,需要检查参比通道和零浓度的响应值 [3] 。
4
Chi²值反映了拟合结果与实验数据的接近程度,这个值越小,代表实验结果与拟合模型越接近。
4. Biacore分析软件中典型的亲和力拟合结果界面 [2] 。
3
关于非特异性吸附的问题
非特异性吸附的来源是多样的,最常见的应该是分析物分子在参比通道芯片表面的吸附,其次可能还来源于分析物样品中其他杂质成分在参比通道或者配体上的非特异性结合,甚至还可能是分析物分子在配体上的吸附(例如小分子在配体蛋白非活性位点的弱结合等)。要判断是否存在非特异性吸附,最主要的判断依据是看Binding to reference这部分参数,该参数反映了每个循环的分析物在参比通道上的吸附情况。作为建议,可以按照以下标准判断:如果Binding to reference的值大于活性通道扣减参比通道(如Fc=2-1)得到信号值的20%,则可以认为存在较显著的非特异性吸附。
要解决非特异性吸附问题,主要可以从以下三方面入手:
1
改变芯片表面或者分析物的性质。比较直接的方法是调换配体与分析物的位置,即固定会发生非特异性吸附的原分析物,将原配体作为分析物流经芯片表面进行分析。然而在蛋白与小分子的互作实验中,固定小分子会面临诸多问题(如上篇中所述),因此这个方案在解决小分子的非特异性吸附中不常用。其次可以考虑改变参比通道的处理方法。在使用CM系列芯片偶联配体进行检测时,参比通道可以不作任何处理,也可以进行活化与封闭。这两种处理方式下的芯片表面性质有所不同,改变处理方式或许可以减弱非特异性吸附。另外,非特异性吸附的来源还可能是分析物中的杂质,那么提高分析物的纯度可能也有助于减弱这种吸附。
2
改变缓冲液条件抑制吸附的发生。非特异性吸附发生所依赖的作用力主要就是离子型相互作用或者疏水型相互作用,前者可以通过提高离子强度来抑制,而后者可以通过添加一定浓度的表面活性剂进行屏蔽。常规缓冲液中NaCl浓度在150 mM附近,可以考虑在原运行缓冲液中额外添加盐(至~300 mM甚至500 mM)。Cytiva提供含有表面活性剂P20的运行缓冲液,工作浓度一般为0.05%。需要注意的是,在提高盐浓度或者加入表面活性剂的过程中,配体与分析物的相互作用可能也会受到一定程度的影响。
3
调整分析物的浓度范围。非特异性吸附往往呈现出非常明显的浓度相关性。对于小分子分析物,有可能发生的情况是,当浓度达到某个值以上时,小分子的溶解情况出现变化,容易发生聚集沉淀等问题,导致非特异性吸附的信号陡然上升。对于上述情况,可以考虑调整分析物的浓度范围,将非特异性吸附的信号控制在相对不显著的范围之内进行实验。当然,分析物的浓度范围的确定还要考虑KD拟合的需要(如上篇中所述),因此这个方法不一定能找到合适的浓度范围。
面对实际出现的非特异性吸附问题时,往往是以上三方面综合考虑,进而尝试解决。
至此,关于Biacore检测蛋白与小分子互作的实验进行步骤和数据分析过程的常见问题也已分享完毕。一个成功的Biacore实验需要在实验设计、样品准备以及结果分析等各阶段进行问题的排查与调整,检测蛋白与小分子互作的实验中可能会出现形形色色的问题,但是造成这些问题的主要原因应该都在这两篇讨论的内容中了,很多情况下未知的现象往往是已知的原因导致的。万变不离其宗,希望这上下两篇的分享能给大家带来一些提示与启发。
文章来源:https://mp.weixin.qq.com/s/5MifecpYb03DUZ_sLj15sQ
